广州中医药大学52.7分新研究:鸦胆子素 A 靶向稳定 NR4A1,为系膜增生性肾小球肾炎治疗开辟新路径
- 2026-02-05 19:31:06
导 读
Introduction

一、研究背景解读
Background
二、研究思路解析
Train of Though
该研究遵循 “临床现象→机制探索→药物筛选→验证转化” 的逻辑链条,分四步层层递进:
三、研究主要结果展示
ResultDemonstraion
NR4A1 是 MsPGN 的关键调控靶点
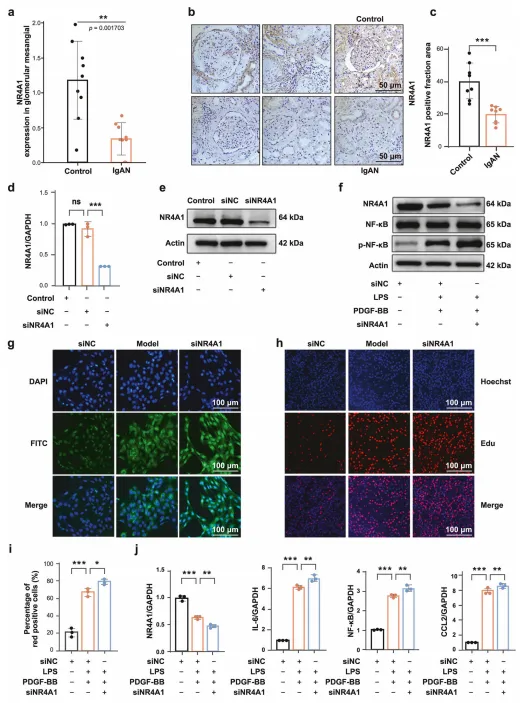
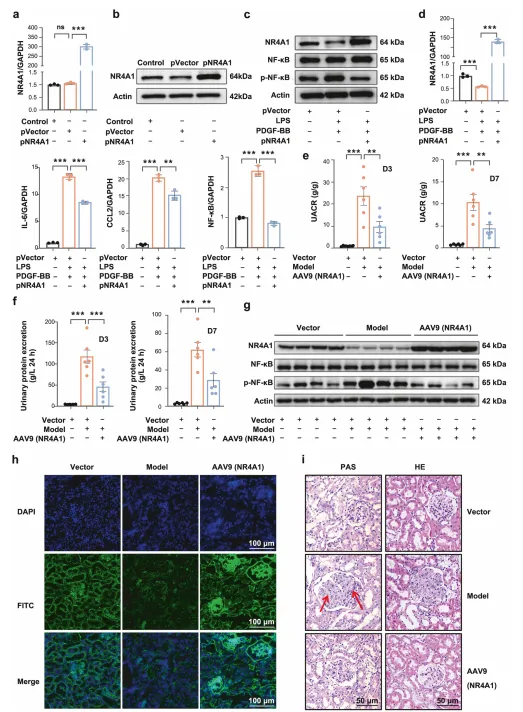
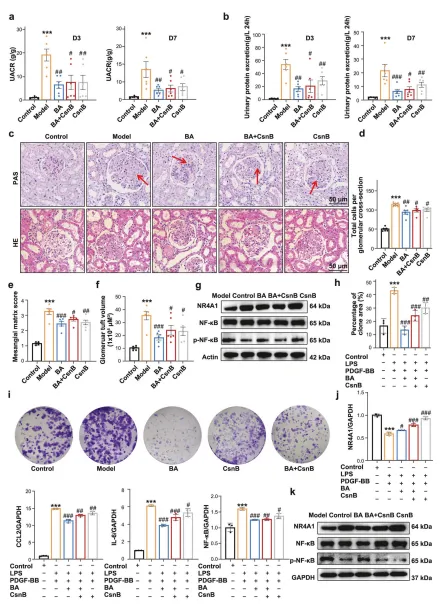
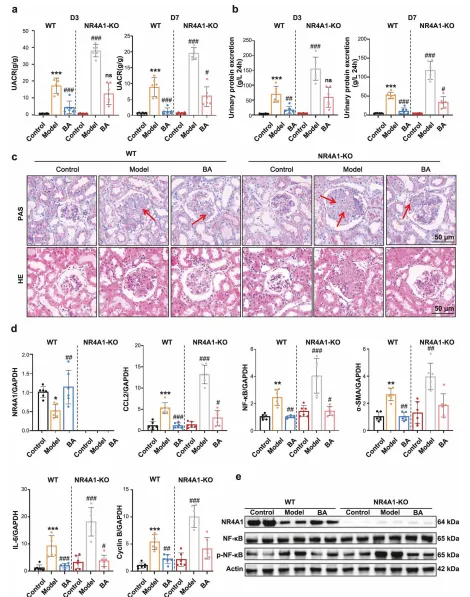
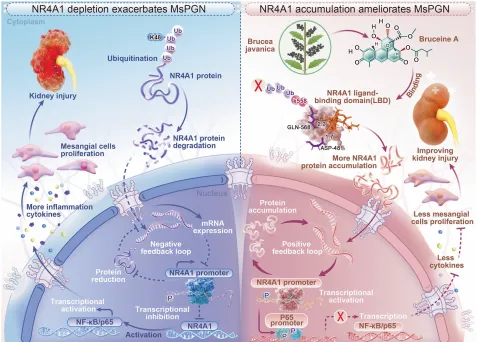
临床样本分析显示,IgAN(MsPGN 最常见类型)患者肾组织中 NR4A1 mRNA 和蛋白水平显著降低,且与肾小球滤过率呈正相关。 细胞实验中,敲低 NR4A1 会促进 LPS/PDGF-BB 诱导的系膜细胞增殖,上调 NF-κB 磷酸化水平及 IL-6、CCL2 等炎症因子表达;过表达 NR4A1 则可抑制上述效应。 动物实验中,AAV9 介导的 NR4A1 过表达可降低大鼠尿白蛋白 / 肌酐比值,减轻系膜细胞增殖和基质沉积,改善肾脏病理损伤。
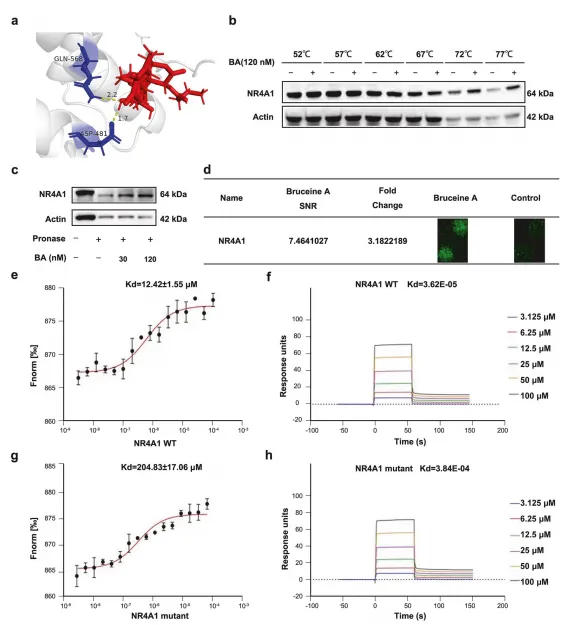
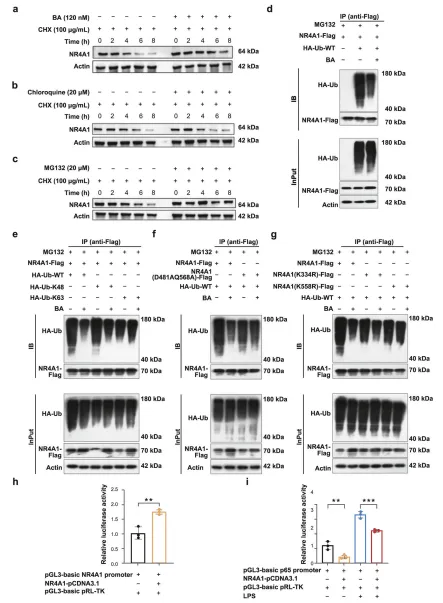
分子对接结果显示,BA 与 NR4A1 配体结合域的 D481/Q568 位点形成 4 个氢键,结合亲和力达 - 8.00 kcal/mol,与已知 NR4A1 激动剂 CsnB 结合位点一致。 MST、SPR 实验证实,BA 与野生型 NR4A1 的解离常数(Kd)分别为 12.42 μM 和 3.62×10⁻⁵ M,而 D481A/Q568A 突变会显著降低结合亲和力。
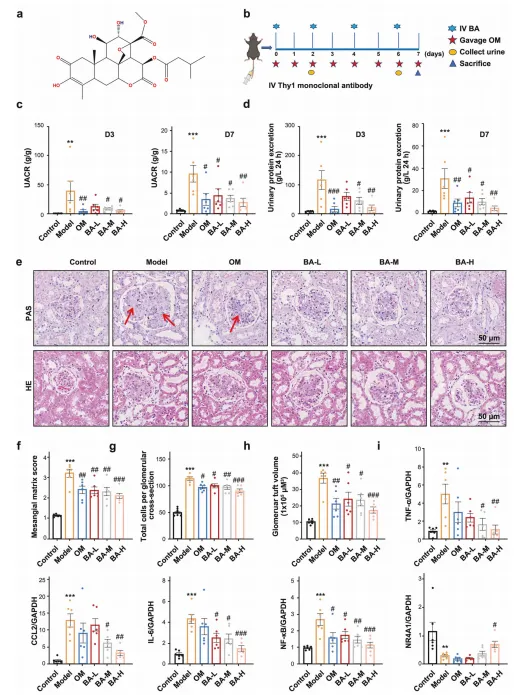
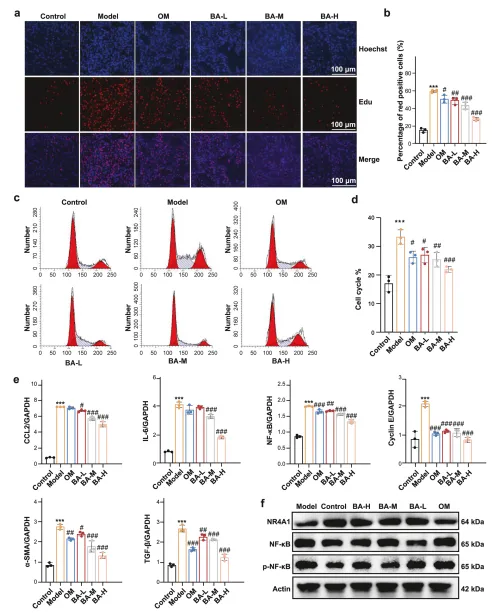
体外实验中,BA 以剂量依赖方式抑制系膜细胞增殖,阻滞细胞周期于 G0/G1 期,下调炎症因子和纤维化相关基因表达。 体内实验中,BA 可显著降低抗 Thy1 肾炎大鼠的 24 小时尿蛋白量,减轻肾小球肥大和系膜基质沉积;在 NR4A1 敲除大鼠中,BA 的治疗效果完全消失。 对比实验显示,BA 的疗效优于 CsnB,且与 CsnB 联用存在竞争关系,提示 BA 是更优的 NR4A1 调控剂。
CHX 追踪实验证实,BA 可延长 NR4A1 的蛋白半衰期,且该效应可被蛋白酶体抑制剂 MG132 模拟,说明 BA 靶向泛素 - 蛋白酶体通路。 泛素化实验显示,BA 选择性抑制 NR4A1 的 K48 位多聚泛素化,对 K63 位泛素化无影响;点突变实验证实,NR4A1 的 K558 位点是关键泛素化位点,该位点突变会完全阻断 BA 的稳定作用。 机制上,稳定的 NR4A1 可自激活自身启动子,增强对 NF-κB 信号的转录抑制,最终抑制炎症级联反应和系膜细胞增殖。
该研究发现,化合物 B8A 能够通过靶向调控 NRAI 的表达与小胶质细胞的活化,显著降低狼疮肾炎模型小鼠的尿蛋白水平,抑制肾脏组织中炎症因子的释放,从而减轻肾脏的病理损伤。这一结果不仅验证了 B8A 在狼疮肾炎中的治疗潜力,也进一步阐明了 NRAI - 小胶质细胞轴在疾病进展中的关键作用,为狼疮肾炎的干预提供了新的候选药物和作用靶点。
该研究证实,B8A 在体外能够通过靶向 NRAI 并抑制 NF-κB 通路的活化,直接抑制小胶质细胞的增殖和炎症因子的释放,从而发挥其抗炎和抗增殖作用。这一结果从细胞层面验证了 B8A 的作用机制,进一步支持了其作为狼疮肾炎潜在治疗药物的价值。
该研究揭示了 RA 在狼疮肾炎中的促病机制:它通过抑制 NRAI 的 K48 连接多聚泛素化与蛋白酶体降解,从而稳定 NRAI 蛋白,激活其下游炎症与增殖通路,并通过 NF-κB 的正反馈环路进一步放大炎症反应,最终加重肾脏损伤。这一发现不仅阐明了 RA 与 NRAI 在疾病中的相互作用,也为狼疮肾炎提供了从泛素化调控角度出发的新干预思路。
四、总 结
Summary
该研究首次阐明了NR4A1 下调在系膜增生性肾小球肾炎进展中的核心作用,并发现天然化合物鸦胆子素 A 可通过靶向结合 NR4A1 的 D481/Q568 位点,抑制其 K48 位泛素化降解,从而稳定蛋白水平。BA 介导的 NR4A1 稳定可通过抑制 NF-κB 信号通路,发挥抗炎、抗系膜细胞增殖的肾脏保护作用,且疗效依赖于 NR4A1 的表达。
该研究不仅揭示了 MsPGN 的全新发病机制,更提供了一种 “蛋白稳定” 的创新治疗策略,区别于传统核受体激动剂的瞬时激活模式,为开发下一代 MsPGN 靶向药物奠定了坚实基础。
https://www.nature.com/articles/s41392-025-02495-2


